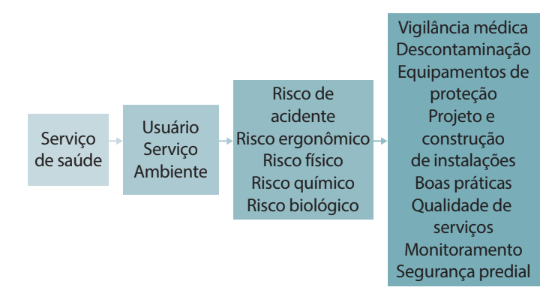
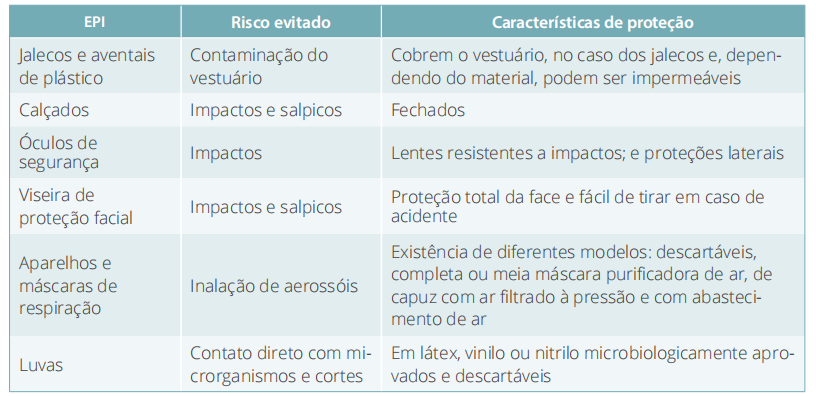
ALBUQUERQUE, M. B. M. Biossegurança, uma visão da história da
ciência.Biotecnologia, Ciência e Desenvolvimento, v. 3,
n. 18, p.
42-45,
2001.
ALMEIDA, A. B. S.; ALBUQUERQUE, M. B. M. Biossegurança:
um enfoque
histórico através da história oral. História, Ciências,
Saúde-Manguinhos, v.
7,
n. 1, p. 171-183, 2000.
ALMEIDA, J. L. T.; VALLE, S. Biossegurança no ano 2010: o futuro
em nossas
mãos?
Bioética, v. 7, n. 2, p. 199- 203, 1999.
ALVES, L. S.; PACHECO, J. S.Biossegurança - Fator
determinante nas
unidades
de atendimento à saúde. Revista Fluminense de Extensão
Universitária, v.
3, n. 2, p. 33-40, 2015
ANVISA. Agência Nacional de Vigilância Sanitária.ANVISA
intensifica
controle de infecção em serviços de saúde. Revista Saúde
Pública, v. 38, n.
3,
p. 475-78, 2004.
.Manual de Tecnovigilância: abordagens de vigilância
sanitária de
produtos para a saúde comercializados no Brasil. Brasília:
Ministério da
Saúde,
2010. 629p.
ARAÚJO, A. S.; MELO, M. D.; ARRUDA, M. L. S.; MENESES, M. D.
Boas
práticas
nos laboratórios de aulas práticas da área básica das
Ciências
Biológicas e
da Saúde.100 f. 2009. Disponível em:
Disponível aqui. Acesso
em: 24 out.
2018.
BRASIL. Lei n° 11.105, de 24 de março de 2005.Regulamenta
os incisos
II,
IV e V do § 1o do art. 225 da Constituição Federal, estabelece
normas de
segurança e mecanismos de fiscalização de atividades que
envolvam organismos
geneticamente modificados – OGM e seus derivados, cria o
Conselho Nacional
de
Biossegurança – CNBS, reestrutura a Comissão Técnica Nacional de
Biossegurança –
CTNBio, dispõe sobre a Política Nacional de Biossegurança – PNB,
revoga a
Lei no
8.974, de 5 de janeiro de 1995, e a Medida Provisória no
2.191-9, de 23
de
agosto de 2001 e os arts. 5o, 6o, 7o, 8o, 9o, 10 e 16 da
Lei no
10.814,
de 15 de dezembro de 2003, e dá outras providências. Brasília:
Presidência
da
República, 2005. Disponível em:
Disponível aqui. Acesso
em: 24 out.
2018.
2021.
.Lei n° 9.431, de 06 de janeiro de 1997. Dispõe sobre a
obrigatoriedade da
manutenção de programa de controle de infecções hospitalares
pelos hospitais
do
País. Brasília: Presidência da República, 1997. Disponível em:
Disponível
aqui. Acesso em: 29 dez. 2017.
Biossegurança em unidades hemoterápicas e laboratórios de
saúde
pública.
Brasília: Editora Ministério da Saúde, 1999. 74p.
Ministério da Saúde. Diretrizes gerais para o trabalho em
contenção com
material biológico Brasília, 2004. 52p.
Ministério da Saúde Diretrizes gerais para o trabalho em
contenção com
Agentes Biológicos.Brasília: Editora do Ministério da
Saúde, 2006c.
52p.
Ministério da Saúde. Portaria n° 1218, de 14 de agosto de
2012Anvisa.
2012. Disponível em:
Disponível aqui. pdf.
Acesso em: 24
out.
2018.
Ministério da Saúde. Portaria n° 2616, de 12 de maio de
1998.Gabinete
do
Ministro, 1998. Disponível em:
Disponível aqui Acesso
em: 24 out.
2018.
Ministério da Saúde. Secretaria de Ciência, Tecnologia e Insumos
Estratégicos.
Departamento de Ciência e Tecnologia Classificação de risco
dos agentes
biológicos. Brasília: Editora do Ministério da Saúde,
2006b. 36p.
Ministério da Saúde. Secretaria de Vigilância em Saúde.
Departamento de
Vigilância Epidemiológica. Biossegurança em laboratórios
biomédicos e de
microbiologia. 3. ed. Brasília: Editora do Ministério da
Saúde,
2006a,
290p.
Ministério do Trabalho e Emprego. Segurança e Saúde no
Trabalho em
Estabelecimentos de Saúde.Brasília: Ministério do
Trabalho e
Emprego,
2005.
CANUTO, D. B.; COSTA, D. U.; SILVA, L. D. Trabalhador de
enfermagem alérgico
à
luva de látex: um estudo sobre outras opções.Revista
Enfermagem UERJ,
v.
15, n. 1, p. 125-129. 2007.
CARDOSO, T. A. O. Biossegurança e qualidade dos serviços de
saúde.Curitiba: Intersaberes, 2016. 203p.
COSTA, M. A. F. Construção do conhecimento em
saúde:estudo sobre o
ensino
de biossegurança em cursos de nível médio da área de saúde da
Fundação
Oswaldo
Cruz. 2005. 154p. Tese (Doutorado em Biociências e Saúde) -
Fundação Oswaldo
Cruz, Rio de Janeiro, 2005.
CUNHA, M. A. L. C.; LEITE, J. L. O ser portador de um cateter
venoso
central: a
percepção do cliente e a contribuição da Enfermagem. Revista
Brasileira
de
Cancerologia v. 54, n. 2, p.139-145, 2008.
GARCIA, L. P.; ZANETTI-RAMOS, B. G. Gerenciamento dos resíduos
de serviço de
saúde: uma questão de biossegurança.Revista CIPA v. 21,
n. 253, p.
2002.
COSTA, M. A. F.; COSTA, M. F. B. Biossegurança: elo estratégico
de
SST.Cadernos de Saúde Pública v. 20, n. 3, p. 744-752,
2004.
GERAIX, A. P. M.; CAMPOS, G. F.; CAMPOS, R. G. Cateter venoso
totalmente
implantável. Revista Terra e Cultura v. 23, n. 44, p.
44-49, 2007.
GOMES, D. C. L. Precauções e isolamento de paciente. In: COUTO,
R. C.;
PEDROSA,
T. M
J. M. Infecção hospitalar e outras complicações não
infecciosas da
doença. Rio de Janeiro: Medsi, 2003.p. 517-526.
GOUREVITCH, P. MORRIS, E. Procedimento operacional
padrão:uma
história de
guerra. São Paulo: Companhia das Letras, 2008. 336p
GUERRERO, G. P.; BECCARIA, L. M.; TREVIZAN, M. A. Procedimento
operacional
padrão: utilização na assistência de enfermagem em serviços
hospitalares.
Revista Latino-Americana de Enfermagem, v. 16, n. 6,p.
966-972, 2011.
GOUREVITCH, P. MORRIS, E. Procedimento operacional
padrão:uma
história de
guerra. São Paulo: Companhia das Letras, 2008. 336p
GUIMARÃES, A. C.; DONALISIOII, M. R.; SANTIAGOI, T. H. R.;
FREIRE, J. B.
Óbitos
associados à infecção hospitalar, ocorridos em um hospital geral
de
Sumaré-SP,
Brasil. Revista Brasileira de Enfermagemv. 64, n. 5,
p.864-9, 2011.
HIRATA, M. H.; FILHO, M. J. B.Manual de
Biossegurança.Barueri:
Manole,
2002. 495p.
HORR, L. et al. Comissão de Controle de Infecção Hospitalar.
Rev. Bras.
Enferm.Brasília, v. 31, n. 2, p. 182- 192, 1978
MARQUES, D. C.; ZUCCHI, P. Comissões farmacoterapêuticas no
Brasil: aquém
das
diretrizes internacionais. Revista Panamericana de Salud
Pública v.
19,
n. 1, 58-63, 2006.
MASTROENI, M. F.Biossegurança aplicada a laboratórios e
serviços de
saúde.São Paulo: Editora Atheneu, 2005. 338p.
MOLINARO, E. M.; CAPUTO, L. F. G.; AMENDOEIRA, M. R. R.
Conceitos e
métodos
para a formação de profissionais em laboratórios.Rio de
Janeiro:
EPSJV,
2009. 290p.
NISHIDE, V. M.; BENATTI, M. C. C. Riscos ocupacionais entre
trabalhadores de
enfermagem de uma unidade de terapia de terapia
intensiva.Revista da
Escola
de Enfermagem da USP, v. 38, n. 4, p. 406-414, 2004
OLIVEIRA, H. M.; SILVA, C. P. R.; LACERDA, R. A. Políticas de
controle e
prevenção de infecções relacionadas à assistência à saúde no
Brasil: análise
conceitual. Revista da Escola de Enfermagem da USPv. 50,
n. 3, p.
505-511, 2016
OSELKA, G. Prontuário Médico.Revista da Associação Médico
Brasileirav.
48, n. 4, p. 275-296, 2002. PENNA, P. M. M.; AQUINO, C. F.;
CASTANHEIRA, D.
D.;
BRANDI, I. V.; CANGUSSU, A. S. R.; SOBRINHO, E.
M.; SARI, R. S.; SILVA, M. P.; MIGUEL, A. S. M. Biossegurança:
uma
revisãoArquivo do Instituto Biológicov. 77, n. 3, p.
555-465, 2010.
PEREIRA, J. D. A. S.; PINEIZ, R. A.; ARAÚJO, R. O.; CANARIM, R.
C.; FAJARDO,
R.
S.; ROSIFINI, M. C. R. A.
Boas práticas de laboratório e biossegurança: prevenção dos
riscos
ergonômicosArchives of Health Investigation,Barueri: v.
3, n. 2, p.
57-63, 2014.
ROCHA, L. F.; ALVES, L. N.; BRASILEIRO, M. E. A Atuação da
comissão de
controle
de infecção em serviços de saúde na Unidade de Terapia
Intensiva: O que
fazer?Revista Eletrônica de Enfermagem do Centro de Estudos
de Enfermagem
e
Nutriçãov. 1, n. 1, 2010.
SANGIONI, L. A.; PEREIRA, D. I. B.; VOGEL, F. S. F.; BOTTON, A.
S.
Princípios de
biossegurança aplicados aos laboratórios de ensino universitário
de
microbiologia e parasitologia.Ciência Rural.v. 43, n. 1,
p. 91-99,
2013.
SCHEIDT, K. L. S.; ROSA, L. R. S.; LIMA, E. F. A. As ações de
biossegurança
implementadas pelas comissões de controle de infecções
hospitalares.Revista
de Enfermagem UERJ, v. 14, n. 3, p. 372-377, 2006.
SCHOLZE, S. H. Biossegurança e alimentos transgênicos.Revista
Biotecnologia,
Ciência e Desenvolvimento v. 2, n. 9, p. 32-34, 1999.
SHATZMAYR, H. G. Biossegurança nas infecções de origem
viral.Revista
Biotecnologia, Ciência e Desenvolvimento.v. 3, n. 18, p.
12-15,
2001.
SILVA, C. P. R.; LACERDA, R. A. Validação de proposta de
avaliação de
programas
de controle de infecção hospitalar.Revista Saúde
Pública.v. 45, n. 1,
p.
121-128, 2011.
SILVA, L. F. N.Reorientação do Gerenciamento de Risco
Hospitalar do
Instituto
Nacional de Traumatologia e Ortopedia 2009. 76 f.
Dissertação
(Mestrado
em Gestão de Políticas, Ciência, Tecnologia e Inovação em Saúde)
– Fundação
Oswaldo Cruz, Rio de Janeiro, 2009.
SKRABA, I.; NICKEL, R.; WOTKOSK, S. R. Barreiras de contenção:
EPI e EPCs.
In:
Biossegurança aplicada a laboratório e serviços de
saúde. São Paulo:
Atheneu, 2006.
TEIXEIRA, P.; VALLE, S. Biossegurança uma abordagem
multidisciplinar.
Rio
de Janeiro: Fiocruz, 2010. 442p.